2025年5月23日,清华大学生物医学工程学院教授、清华-北大生命联合中心研究员杜亚楠团队在 Nature Biomedical Engineering (《自然生物医学工程》) 期刊发表题为Tension- induced Directional Migration of Hepatic Stellate Cells Potentially Coordinate Liver Fibrosis Progression的研究论文。
研究背景
肝纤维化是世界性的健康挑战。肝纤维化导致细胞外基质的过度沉积,形成纤维状的疤痕组织,从而扰乱肝脏的正常生理结构。在长期的慢性损伤过程中,肝纤维化会逐渐进展为肝硬化,进一步发展至肝脏功能衰竭或诱发肝细胞癌。肝纤维化的大多数致死发生于晚期。因此阐明早期肝纤维化如何进展为肝硬化的机理可启发新型治疗思路和手段,具有重要临床意义。
临床上对肝纤维化的各类分期标准均与胶原蛋白在肝小叶的沉积模式相关。其中,Metavir和另外 3 种肝纤维化分期评分体系 (图1) 均表明,早期胶原沉积主要呈点状在汇管区(portal tracts) 附近分布,在晚期会出现“汇管区到汇管区”(portal to portal)的方向性分布,产生 “纤维间隔”(Septa),然而如何产生这种方向性胶原蛋白分布的机制尚不明确。
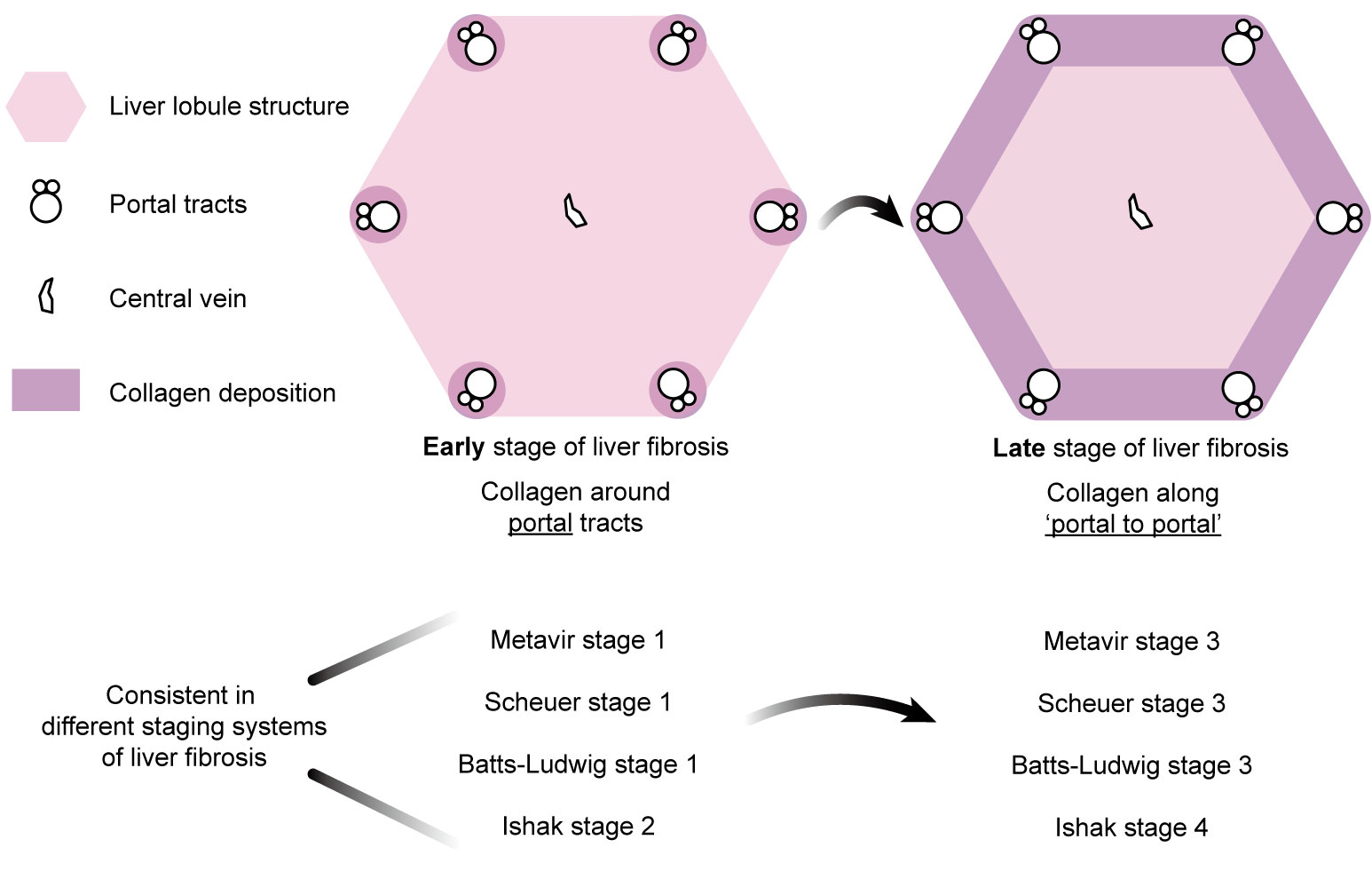
图1 临床常用肝纤维化分期体系中早期和晚期胶原蛋白的空间分布具有方向性
1.制备具有肝小叶结构的体外模型。目前大部分肝纤维化体外模型缺乏肝小叶结构。尚不能重现肝纤维化进程中胶原蛋白的方向性分布和“纤维间隔”。
2.探究生物力学对肝纤维化进程中方向性胶原沉积的调控作用。目前对肝纤维化进展的机制主要基于生化因子扩散,但因子各向同性扩散所产生的肝星形细胞激活并不能解释胶原沉积在“汇管区到汇管区”的方向性分布。细胞对周围基质的张力在不同方向上可维持各向异性,潜在可解释胶原沉积的方向性。
总体框架
本研究实现了跨尺度的系统研究 (图2)。
•器官尺度上:在小鼠肝纤维化模型中,解析表征了 “汇管区到汇管区”具有方向性的胶原沉积和肝星形细胞分布
•组织尺度上:首次构建具有肝小叶结构的肝纤维化体外模型,可重现体内肝纤维化进程中肝星形细胞和胶原方向性分布和纤维间隔的形成
•细胞尺度上:使用体外胶原拉伸系统,模拟肝纤维化模型中重塑胶原产生的应变,发现肝星形细胞在“重塑胶原”上呈现方向性迁移,其迁移速度和细胞激活状态与应变大小均相关
•分子尺度上: 证明力响应蛋白LIMD1 的液-液相分离参与了对细胞方向性迁移的调控
图2 研究总体框架
主要结果
本研究使用四氯化碳诱导的小鼠肝纤维化体内模型,表征早期和晚期的病理特征。肝星形细胞是肝纤维化进程中的主要效应细胞,可大量分泌胶原导致其沉积。本研究发现,在肝纤维化早期,静息态肝星形细胞在肝小叶中呈现弥散性分布,激活态肝星形细胞在汇管区附近聚集;在肝纤维化晚期,静息态肝星形细胞部分在汇管区附近聚集,而激活态肝星形细胞与重塑胶原同时形成了“汇管区到汇管区”的方向性分布(形成纤维间隔)。本研究构建了一种基于微组织加工技术的体外仿生“肝小叶”模型,能够重现这种胶原和肝星形细胞的分布趋势和动态变化 (图3)。
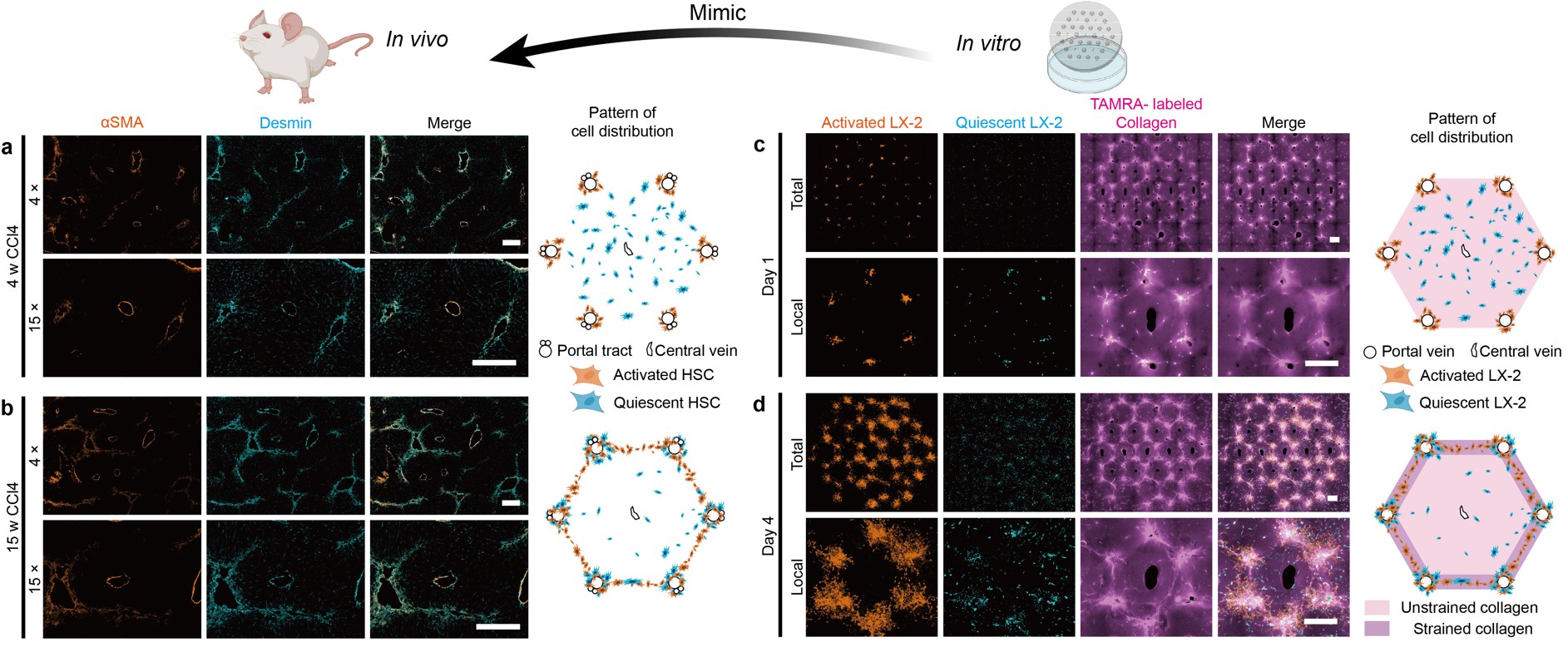
图3 体外模型重现“肝小叶”结构并可模拟肝纤维化早期和晚期肝星形细胞和胶原的方向性分布和动态变化
为了模拟肝小叶的六边形结构,本研究设计和制作了一种微型PDMS (聚二甲基硅氧烷)印章。这种制备方法结合了加工深度高但分辨率低的激光雕刻技术,以及加工深度低但分辨率高的光刻蚀技术 (图4)。
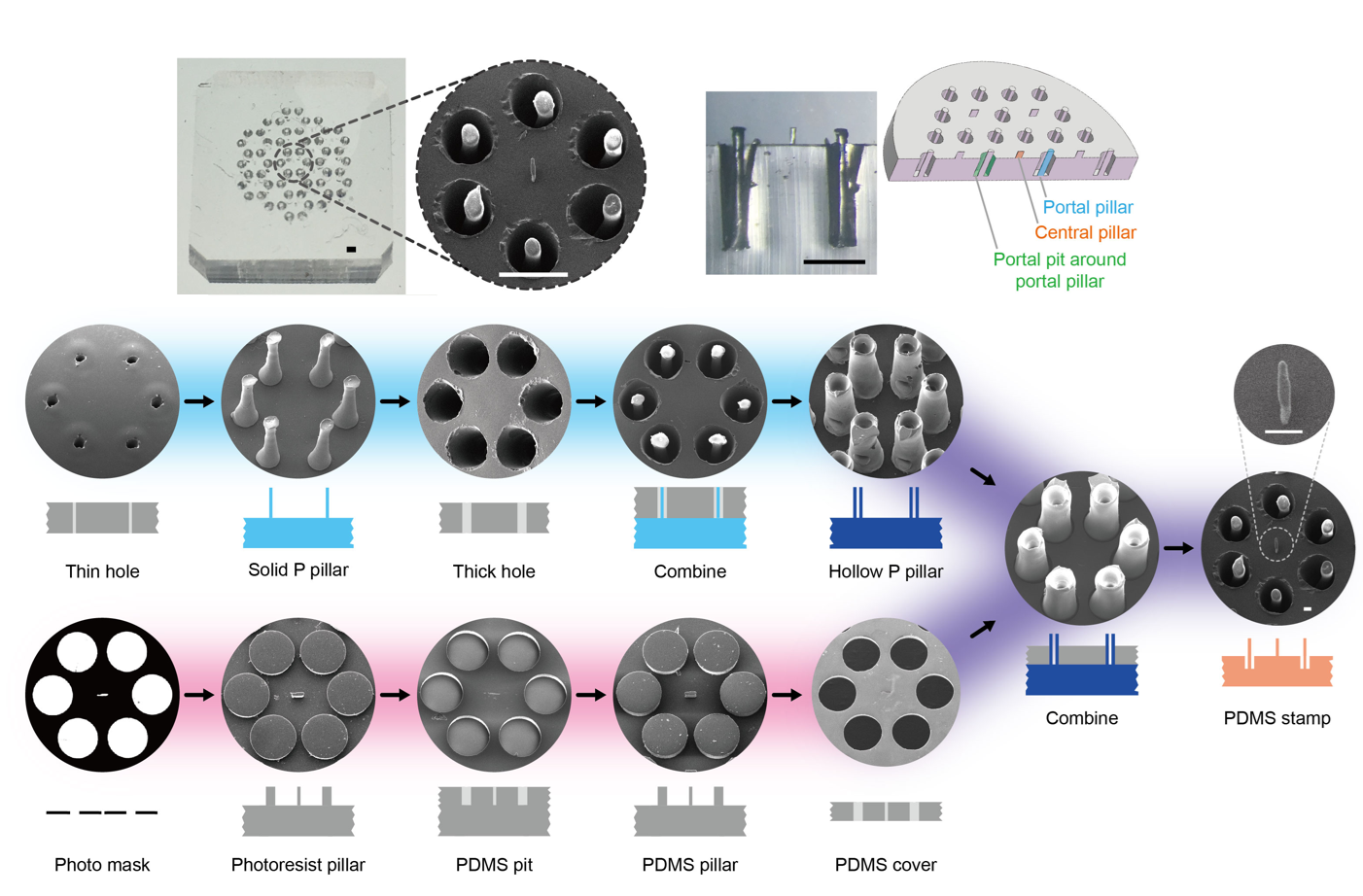
图4 用于制备“肝小叶”体外仿生模型的PDMS印章
这种PDMS印章使用时的方法类似在纸上盖章。在细胞沉降到印章内的孔状结构后,可以转印到胶原蛋白上,以形成模拟肝纤维化早期细胞分布的体外模型,即激活态肝星形细胞在汇管区域聚集,静息态肝星形细胞弥散分布于肝小叶中 (图5)。
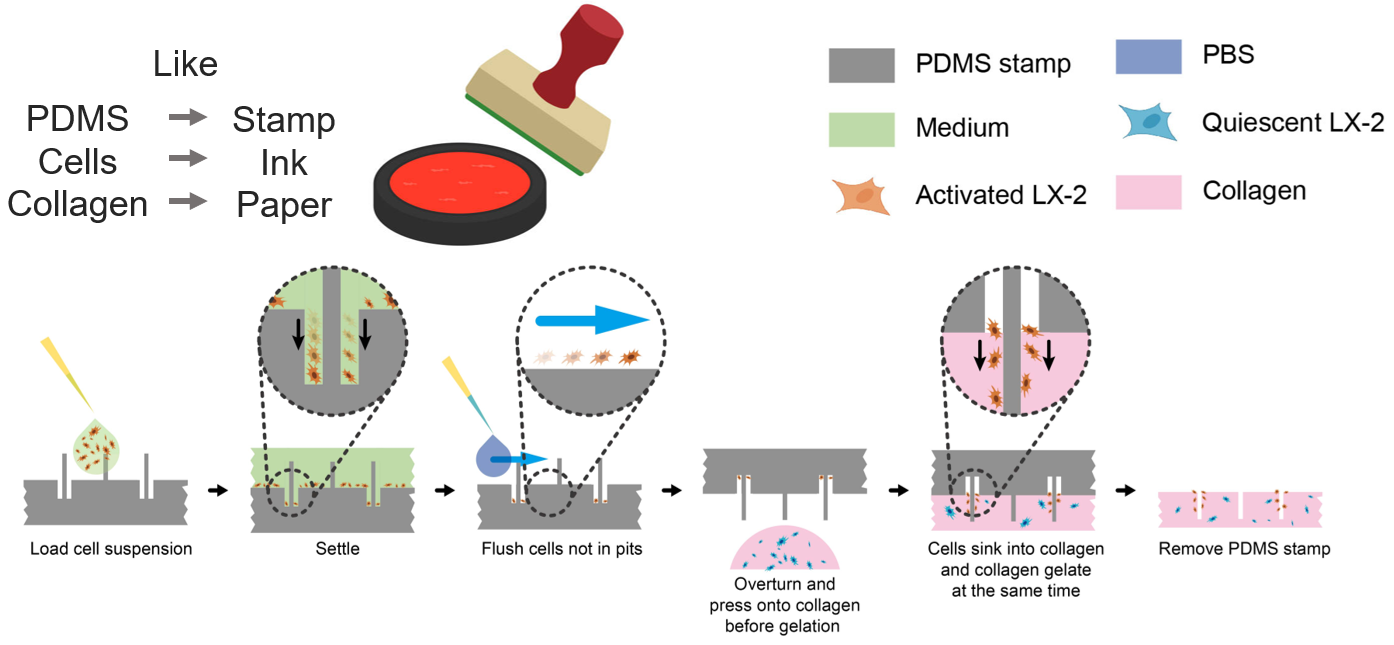
图5 使用PDMS印章重现肝纤维化早期的星形细胞分布
由于巨噬细胞在肝脏纤维化进程中具有重要调控作用,本研究也尝试将具有M1极化表型的巨噬细胞加入到该微组织模型中进行共培养,并观察到其对肝纤维化进展可产生一定的抑制作用 (图6)。
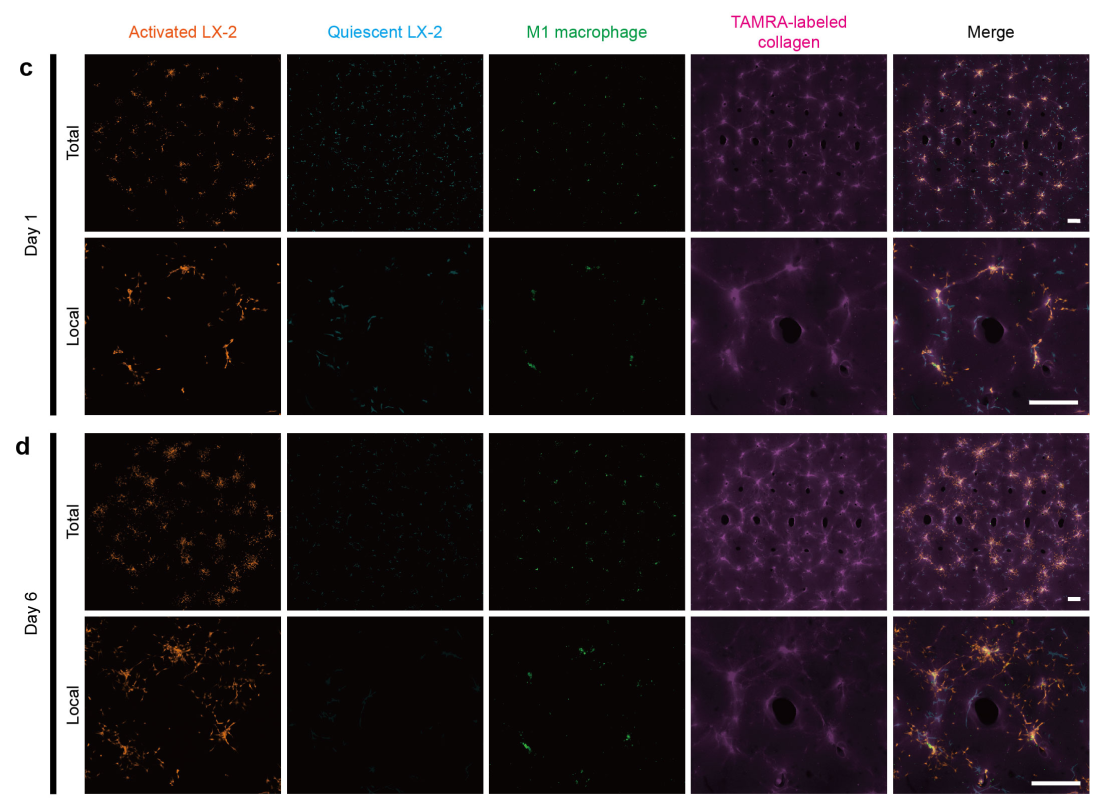
图6 M1型巨噬细胞和肝纤维化微组织模型共培养
接下来探究了在肝纤维化体外模型中,调控细胞分布是否有生物力学因素的参与(图7)。利用激光微切割技术,发现平行于“汇管区到汇管区”方向切割时,胶原蛋白不会张开;但如果是垂直方向的切割,则会有明显张开。提示在“汇管区到汇管区”方向上存在张力,并且先于细胞形成“汇管区到汇管区”的条带状定向分布。
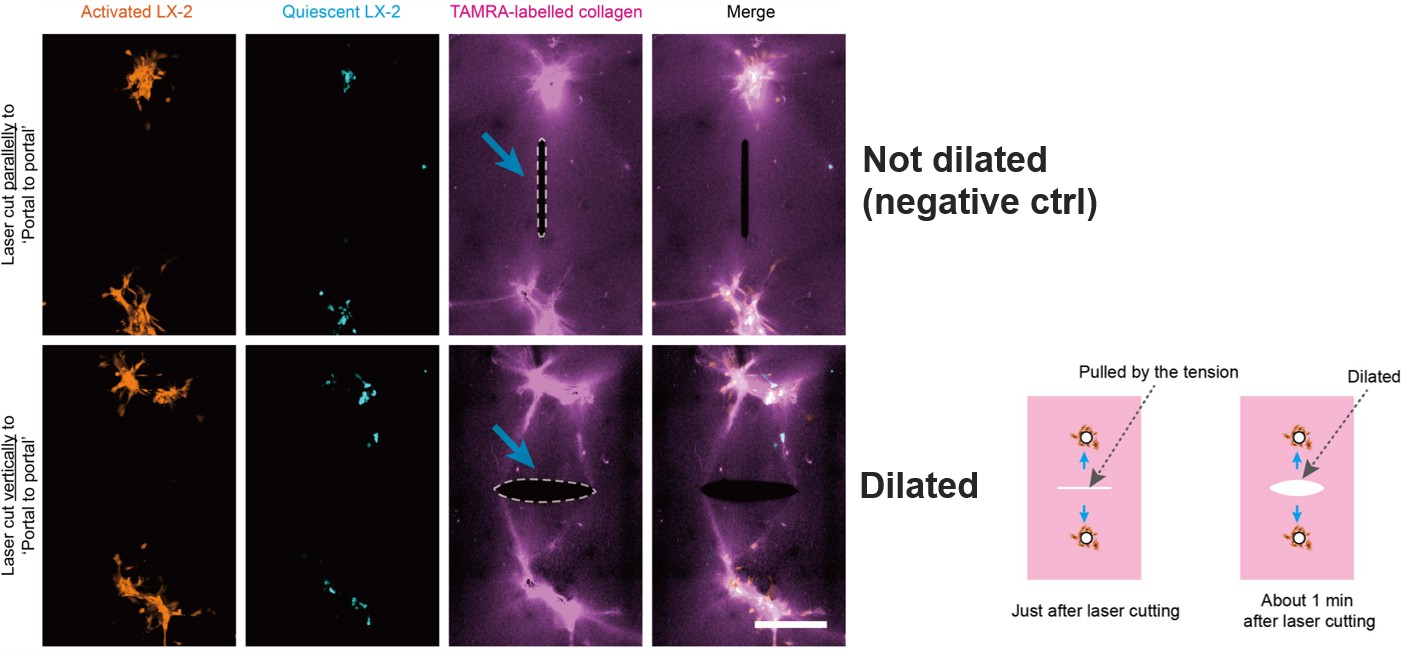
图7 激光微切割方法证明“汇管区到汇管区”方向上存在张力
在激光切割后培养过程中发现,不切割和平行于“汇管区到汇管区”方向切割后,“汇管区到汇管区”的细胞条索状分布仍可出现。但如果是垂直方向的切割,细胞分布则会出现“汇管区到切口边缘”的现象,和有限元分析中的张力分布模拟结果相符 (图8)。该结果进一步提示,张力是肝纤维化体外模型中激活态星形细胞产生“汇管区到汇管区”方向性分布的主要原因。
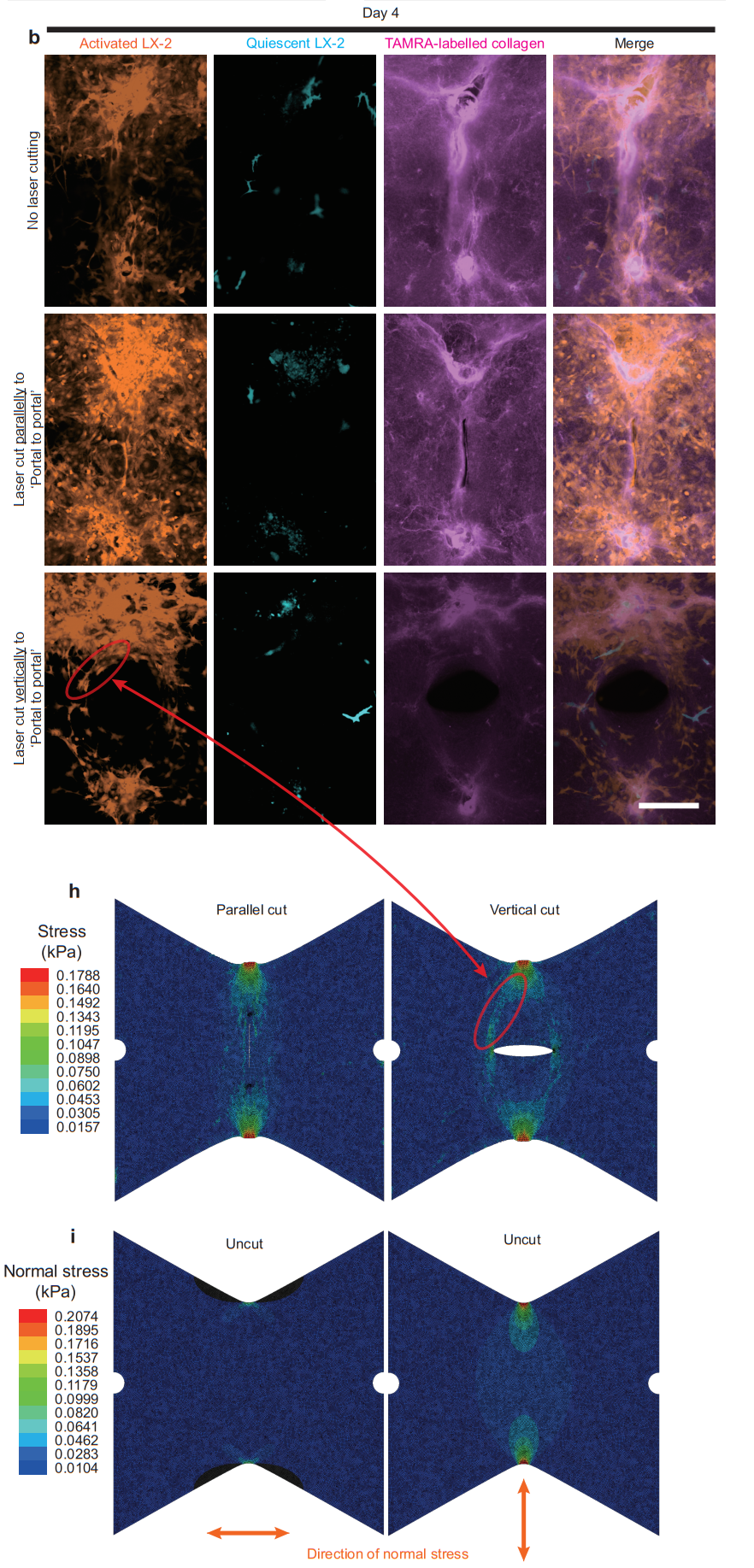
图8 激光微切割方法提示张力分布对细胞分布有调控作用
接下来,为了精确探究张力、胶原蛋白和细胞之间的相互作用,设计了一种能适配共聚焦成像的拉伸装置,系统探究了胶原蛋白在受到仿生应变后的应力增强(stiffening) 和定向排列(alignment)等特征变化 (图9)。
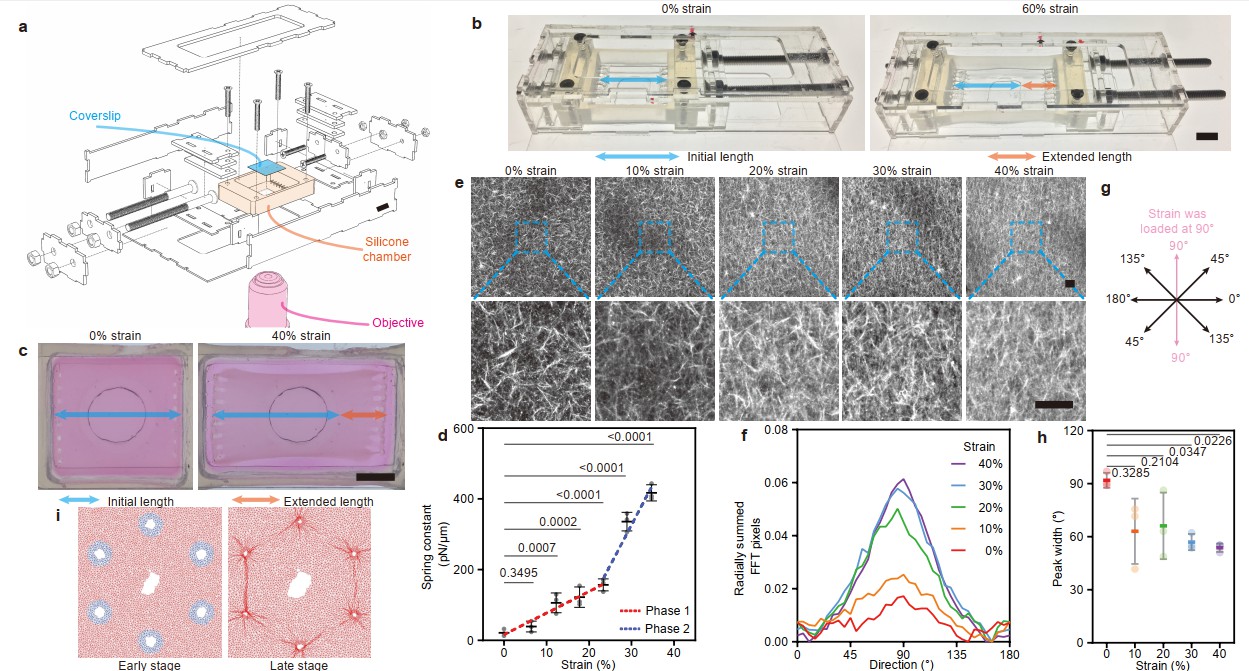
图9 张力对胶原蛋白产生应力增强和定向排列
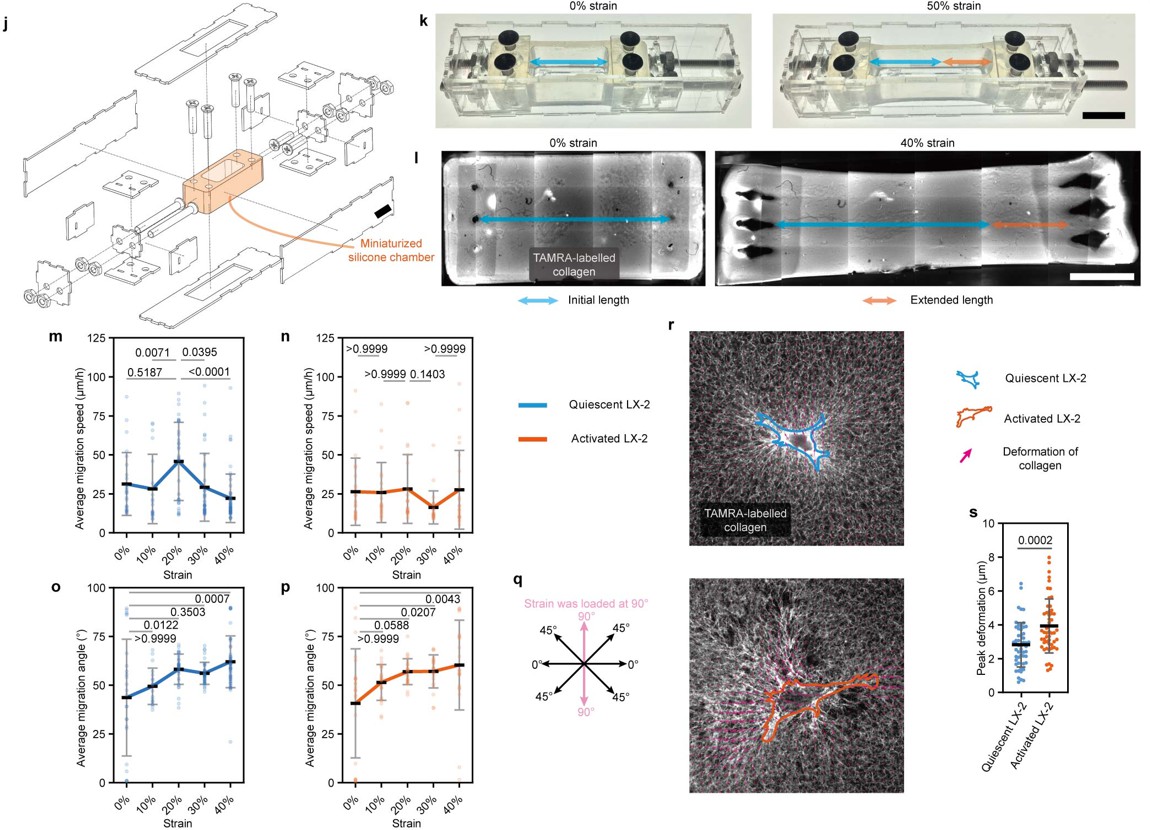
图10 通过微型拉伸装置表征肝星形细胞在不同应变的胶原蛋白上的迁移特性
在将这种拉伸装置微型化后,可与活细胞工作站适配,系统表征了肝星形细胞在拉伸后“重塑胶原”上的迁移特性。静息态肝星形细胞随着应变增加,迁移速度先上升后下降,而激活态肝星形细胞的迁移速度不受应变的调控。同时静息态和激活态细胞,在拉伸强度增加后,迁移方向都会向拉伸方向偏移 (图10)。潜在解释了张力分布调控的胶原重塑以及静息态/激活态肝星形细胞的动态分布特征。
最后探究了细胞在胶原蛋白上定向迁移中可能参与的分子机制。方向性的物理信号通过与胶原蛋白结合的整合素 (integrin)传递到细胞膜内,激活了与整合素结合的力响应蛋白LIMD1的液-液相分离 (liquid-liquid phase separation),使其产生局部聚集,募集了更多的黏着斑组件和肌动蛋白相结合,促进了细胞在张力方向上的定向迁移。该机制进一步得到基于免疫荧光染色、荧光猝灭后恢复实验和敲除实验结果的验证(图11)。
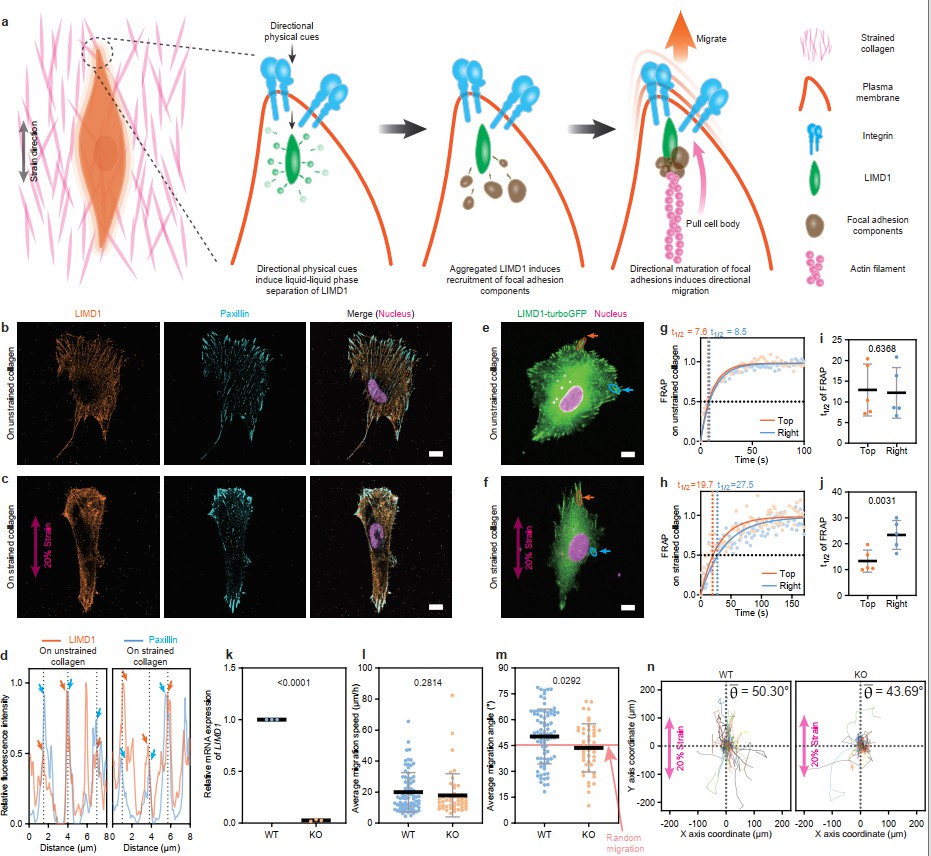
图11 细胞在拉伸后胶原蛋白上定向迁移的分子机制
综上,本研究通过制备具有肝小叶结构的肝纤维化体外模型,提出并验证了可解释肝纤维化早期和晚期中细胞和胶原方向性分布的潜在机制:即分布在汇管区的激活态肝星形细胞通过产生张力,导致胶原蛋白发生应力增强和定向排列。其中应力增强效应使弥散在肝小叶中的静息态肝星形细胞更倾向于迁移并驻留在汇管区附近,从而在晚期出现部分聚集。而定向排列效应使激活态肝星形细胞沿张力方向迁移,从而出现“汇管区到汇管区”的方向性分布,形成“纤维间隔” (图12)。本研究对揭示肝纤维化进展机制和开发潜在的新型干预疗法具有重要价值。
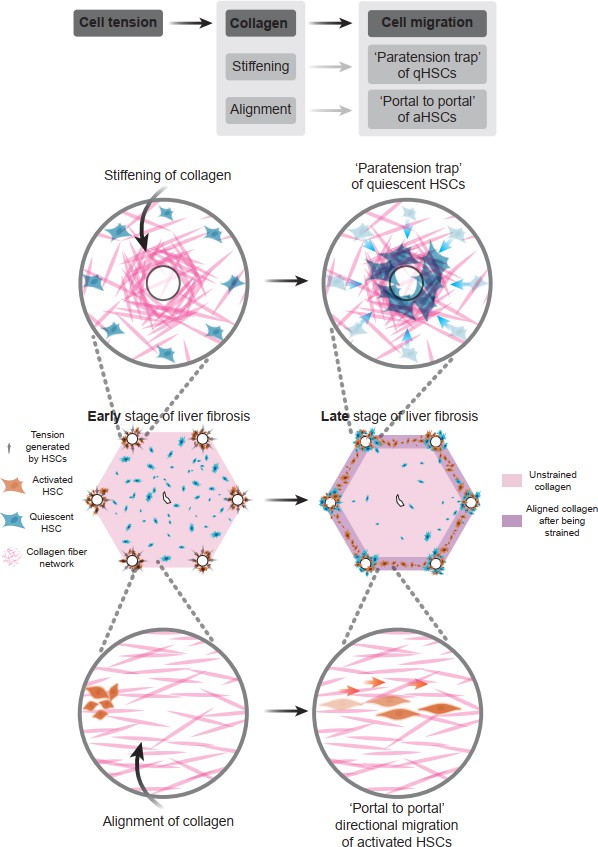
图12 肝纤维化进展中细胞产生的张力如何调控胶原重塑和细胞分布的总结性机制
清华大学生物医学工程学院教授、清华-北大生命联合中心研究员杜亚楠为该文章的通讯作者,清华大学生命科学学院博士周律为第一作者,医学院博士生石子敖、航空航天学院本科生杨学思、生物医学工程学院博士生曾佳楠、尤志峰、医学院博士生张钰莹、多伦多大学朱芷玥、医学院博士生刘志强、医学院博士生牛宇迪、医学院硕士生于鸿升、生命学院博士生何金亮对本研究有重要贡献。北京大学基础医学院系统生物医学研究所吴聪颖教授对本研究有重要指导。该研究得到了国家基金委杰出青年项目、重点项目和国际合作项目(82125018,32430058和82061148010)的支持。
论文链接:https://www.nature.com/articles/s41551-025-01381-0
杜亚楠实验室前期在肝纤维化体外病理模型方向发表的相关参考文献:
[1]Liu, L., You, Z., Yu, H., Zhou, L., Zhao, H., Yan, X., ... & Du, Y. (2017). Mechanotransduction-modulated fibrotic microniches reveal the contribution of angiogenesis in liver fibrosis. Nature materials, 16(12), 1252- 1261.
[2]Liu, L., Yu, H., Zhao, H., Wu, Z., Long, Y., Zhang, J., ... & Du, Y. (2020). Matrix-transmitted paratensile signaling enables myofibroblast–fibroblast cross talk in fibrosis expansion. Proceedings of the National Academy of Sciences, 117(20), 10832-10838.
[3]Long, Y., Niu, Y., Liang, K., & Du, Y. (2022). Mechanical communication in fibrosis progression. Trends in cell biology, 32(1), 70-90.
[4]Lyu, C., Kong, W., Liu, Z., Wang, S., Zhao, P., Liang, K., ... & Du, Y. (2023). Advanced glycation end- products as mediators of the aberrant crosslinking of extracellular matrix in scarred liver tissue. Nature biomedical engineering, 7(11), 1437-1454.