微水凝胶(微米尺度的水凝胶材料),已被广泛应用于药物递送、细胞包裹和组织工程等领域。从制备方法上,微水凝胶可分为物理交联微水凝胶(Physically Crosslinked Microgel,PCM)和化学交联微水凝胶两种。相比于化学交联,物理交联赋予了微水凝胶一些独特的优势。例如,PCM制备避免了生物毒性化学交联剂的参与,故其在生物活性物包裹、体外与细胞共培养和体内递送等领域具有理想的生物相容性。此外,由于物理交联相对动态的性质,PCM拥有一些特殊的机械性能,例如低刚度、高变形性和显著的粘弹性等。然而,目前尚缺乏工艺简便、高效制备生化、机械、结构可控的物理交联微凝胶PCM的方法。2024年6月6日,清华大学生物医学工程学院杜亚楠教授课题组在Advanced Materials(《先进材料》)杂志上发表了题为"Water Transport-Induced Liquid-Liquid Phase Separation Facilitates Gelation for Controllable and Facile Fabrication of Physically Crosslinked Microgels"的文章,报道了一种新型PCM制造方法。本工作首次发现乳液中水转移现象能够诱发液滴内的液-液相分离(Liquid-Liquid Phase Separation, LLPS),进而促进物理凝胶化。并以此为基础提出了一种创新的PCM制备方法。通过便捷的单次乳化制备材料组分、机械特性、尺寸、结构可控的PCM。并证明了其良好的应用潜力。
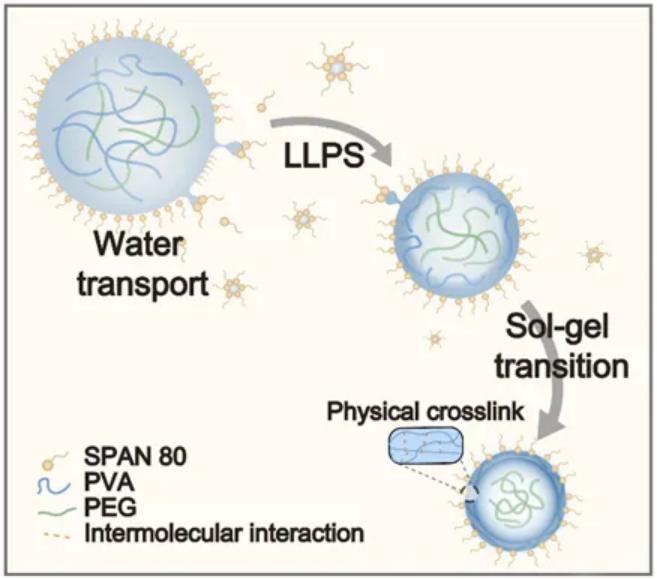
图1. 发现乳液中水转移(Water transport)可诱发连续液液相分离(LLPS)和物理交联(Physical crosslink),促进微凝胶形成
该工作首先发现并报道了一个有趣的现象:乳化后,含有聚乙烯醇(PVA)和聚乙二醇(PEG)的水相乳液液滴内会迅速发生LLPS。重要的是,随着乳液静置时间的延长,这些LLPS液滴内部自发产生了凝胶化,形成了微水凝胶。进一步的深入研究揭示了这些微水凝胶是基于PVA材料的PCM,并且其交联主要是通过分子间的氢键和晶体的形成来实现。值得关注的是,当PVA的初始浓度保持一定时,只有在LLPS发生的情况下,物理凝胶化过程才会发生,这突出了LLPS在物理凝胶化过程中的关键作用。此外,研究还探讨了水转移在物理凝胶化过程中的作用。实验数据表明,水转移不仅能够通过增加液滴内部溶质的浓度来诱导LLPS,而且与LLPS协同促进了PVA的交联和物理凝胶化过程。这些发现为理解PCM的形成机制提供了新的视角,并为相关材料的设计与应用铺平了道路。
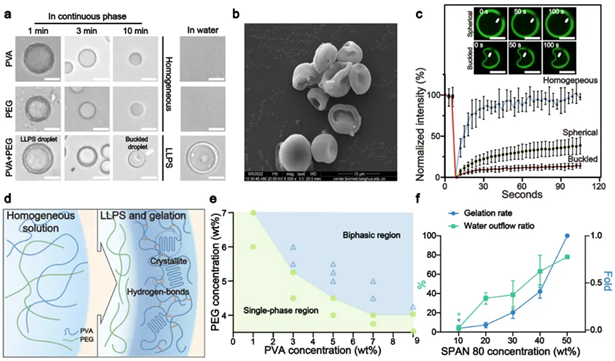
图2. 解析水转移、LLPS和物理凝胶化之间的相关性(a)LLPS液滴自发转变为微水凝胶;(b)使用扫描电镜表征微水凝胶;(c)使用荧光淬灭恢复实验证明LLPS对PVA分子交联的促进作用;(d)LLPS液滴内PVA的交联机制;(e)PVA和PEG的相图证明其二者之间的LLPS会被水转移引起的浓度上升而引发;(f)水转移对于LLPS液滴凝胶化的促进作用。. 患者来源的pLCO模型反映了亲本肿瘤组织实质部分的微环境特征.
基于上述针对水转移、LLPS以及物理凝胶化之间关联的探究,本研究构建了一种创新的PCM制造系统。该系统能够制备基于不同材质(天然和合成高分子)和尺寸(百纳米到百微米)的PCM,且可以对其结构(多腔体结构、核-壳结构到多核结构)和机械性能(杨氏模量从百帕到十千帕)进行系统性调控。同时,整个PCM的制备过程仅需一步乳化操作,随后的LLPS和物理凝胶化过程将在水转移的驱动下自动进行,这表明了系统良好的便捷性。在应用探索方面,研究首先证实了PCM在生物封装领域的潜力,即其能够支持细菌在其内部的包裹与增殖。进一步,通过将系统优化为全水相体系,成功实现了对真核细胞的包裹,拓宽了PCM的应用范围。此外,通过在PCM表面功能化修饰抗-CD3抗体和抗-CD28抗体,并与T细胞共培养,成功实现了T细胞的体外激活。上述成果分别对PCM的内部和表面空间加以利用和开发,证实了PCM在生物医学领域的广泛应用前景。

图3. 利用水转移引发的LLPS建立可控、便捷的PCM制备系统,并验证其在生物医学应用中的前景
综上,本研究基于乳液中水转移引发的连续LLPS和物理凝胶化的现象发现,建立了可控且便捷的PCM制造方法,并验证了其良好的应用前景。本工作对乳液科学和微凝胶制造工程领域提供了新的机制和制造方法,并为PCM未来在生物分子释放或呈递、细胞培养等生物医学相关场景中的应用提供了良好基础。
本论文的通讯作者为清华大学生物医学工程学院教授、清华-北大生命联合中心研究员杜亚楠,第一作者为清华大学生物医学工程学院硕士生陈昊珂。该研究得到国家杰出青年科学基金(no. 82125018)、北京市自然科学基金(no. Z230016)、国家自然科学基金(no. 92068204)的支持,项目同时得到了清华大学化学工程系徐建鸿教授研究团队的大力支持。