2024年6月19日,清华大学生物医学工程学院刘鹏研究员课题组联合北京航空航天大学陈晓芳副教授课题组、北大人民医院王俊院士团队在国际期刊《Advanced Science》发表研究论文《Patient-Derived Tumor Organoids Combined with Function-Associated ScRNA-Seq for Dissecting the Local Immune Response of Lung Cancer》。该研究建立了保留患者肿瘤实质微环境特征的原代肺癌类器官模型(primary lung cancer organoids,pLCOs),并基于功能性单细胞转录组测序平台(function-associated single-cell RNA sequencing,FascRNA-seq)解析了单个肿瘤类器官球模型在PD-1免疫检查点抑制(αPD-1)作用下的肿瘤免疫响应,从而为肿瘤类器官免疫模型的多组学联合解析建立了新颖的分析模式,并为评估肺癌患者的临床免疫疗效以及解析相关的分子机制提供了有力工具。基于免疫检查点抑制剂(immune checkpoint blockade,ICB)的肿瘤免疫疗法是近十余年来实体瘤治疗的突破性进展,亦使广大肺癌患者从中受益。然而,目前免疫检查点抑制剂单药在肺癌临床治疗中的有效率仅为20~30%,亟需建立能够保留患者肿瘤免疫微环境(tumor immune microenvironment,TIME)的体外肿瘤模型用于评估患者临床的免疫响应,并探索其背后的药物起效条件与下游免疫图景。而肿瘤类器官(tumor organoids)作为近年来新兴的肿瘤体外模型,凭借其与亲本肿瘤组织的高度一致性和与动物模型相比更低的成本,已经在个性化精准医疗方向得到了广泛的应用与认同。因此,如何建立保留患者肿瘤组织特征的肿瘤类器官,并以多组学视角解析与模型响应相关的分子机制成为了肿瘤类器官模型在肿瘤免疫治疗中开展应用的关键问题。为了实现上述研究目的,刘鹏课题组首先建立了功能性单细胞转录组测序平台(FascRNA-seq),该平台硬件部分由模块化超疏水微阵列芯片(modular superhydrophobic microarray chip,MoSMAR-chip)和单细胞/单类器官自动化分布系统(automated single-cell/organoid distribution instrument,SCDI)共同组成,可面向来自单个类器官球水平的少量稀有细胞样本实现高效回收和准确分布,从而形成芯片上顺序排布的单细胞液滴阵列。而通过沿用课题组先前在Grouped-seq技术中所开发的二维数组式编码探针,则能够进一步将单细胞转录组测序数据回溯至其类器官球来源中,从而以类器官球的表型信息为监督开展单细胞数据分析,进而形成整套FascRNA-seq技术流程(图1)。
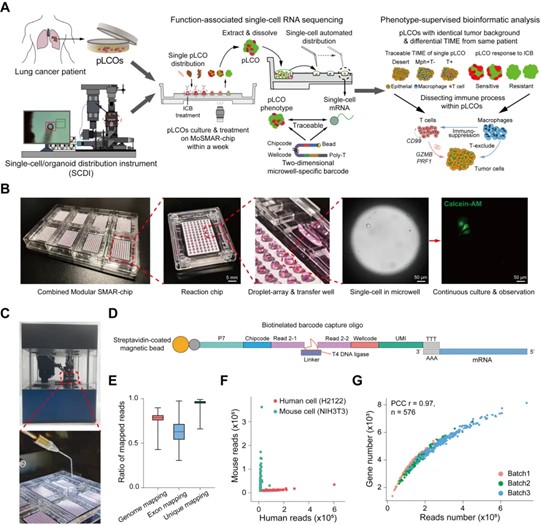
图1. FascRNA-seq平台与基于该平台的原代肺癌类器官免疫模型分析流程
依托该平台,团队进一步面向7例肺癌患者样本来源的171例单个肿瘤类器官球模型建立了其单细胞转录组图谱,并归纳了包括免疫沙漠型、T细胞排斥型以及T细胞浸润型在内的三种典型微环境特征。而通过将上述患者的原代肺癌类器官模型的微环境特征与其肿瘤组织切片mIHC评估的实质部分特征进行比对,研究发现两者在上皮细胞、巨噬细胞和T细胞等关键微环境成分上具备强相关性,证明了患者来源的原代肺癌类器官模型准确反映了患者肿瘤组织实质部分的微环境特征,从而为进一步在单个肿瘤类器官球层面开展αPD-1给药处理与模型响应解析打下了基础(图2)。
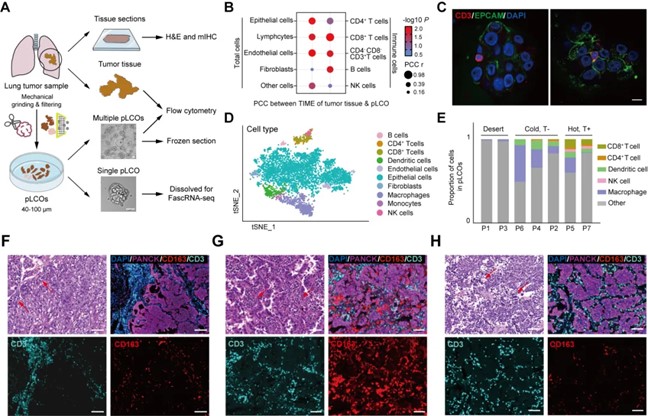
图2. 患者来源的pLCO模型反映了亲本肿瘤组织实质部分的微环境特征
通过进一步将原代单个肺癌类器官球模型的αPD-1药敏响应表型与其单细胞转录组数据进行整合分析,研究论证了pLCO在αPD-1作用下以CD8+T细胞为主介导的模型肿瘤免疫敏感响应,进而解析了CD8+T细胞以PRF1与GZMB基因共表达实现模型中肿瘤效应杀伤的途径(图3)。同时通过分析pLCO模型中与CD8+T细胞浸润数量相关的差异激活方式,初步揭示了CD99是介导该过程中CD8+T细胞效应激活的潜在调节因子(图4)。
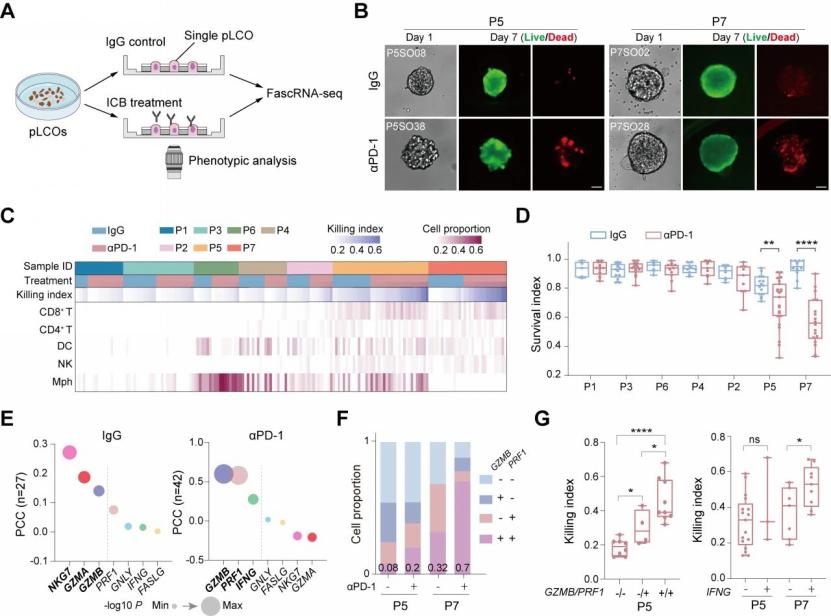
▲ 图3. pLCO中CD8+T细胞在αPD-1作用下以PRF1与GZMB基因共表达实现的效应杀伤
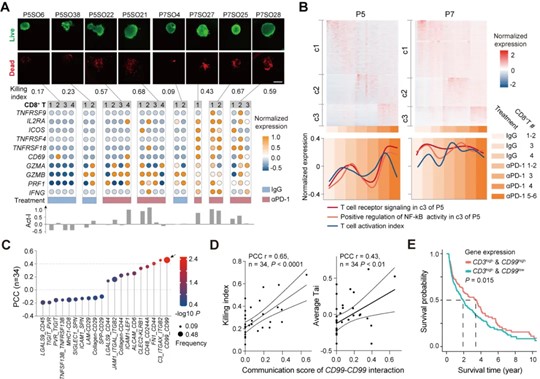
图4. pLCO中以CD99互作介导的CD8+T细胞激活与模型药敏响应
此外,研究亦发现了pLCO模型中的T细胞浸润程度与微环境中的M2型肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)比例存在显著的负相关性(图5),进而解析了具备该特征的TAM通过作用于T细胞的直接方式以及与肿瘤上皮细胞互作的间接方式排斥T细胞浸润以抑制肿瘤免疫进程的作用。
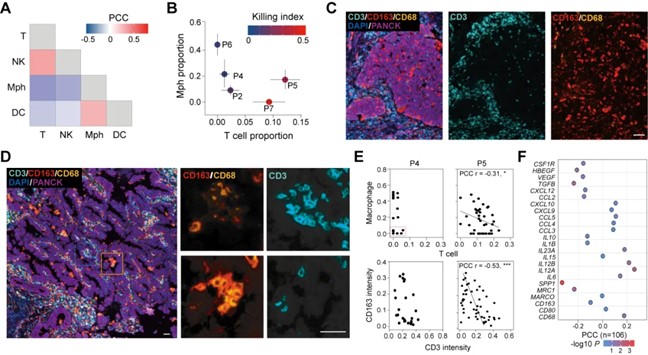
图5. pLCO中M2型巨噬细胞与T细胞浸润的负相关性解析
综上所述,研究团队首先建立了一套功能性单细胞转录组测序平台,使其能够面向包括肿瘤类器官在内的样本以高利用率开展表型与单细胞转录组整合的组学分析。依托该平台,研究论证了患者来源的pLCO模型准确反映了其亲本的肺癌肿瘤组织实质部分的微环境特征。进一步地,通过对单个pLCO进行αPD-1处理并以模型表型数据作有监督的单细胞转录组分析,研究解析了pLCO中CD8+T细胞实现效应与激活作用的分子机制,以及模型中M2型巨噬细胞与T细胞的互作关系,从而为理解肿瘤免疫疗法下的微环境图景与肿瘤免疫进程提供了新颖的策略,并有望进一步与临床免疫疗效形成比对评估并开展相关机制解析。
清华大学生物医学工程学院博士生刘畅、博士生李恺怡和北京大学人民医院胸外科主任医师隋锡朝为本文共同第一作者,刘鹏、陈晓芳和王俊院士为该论文通讯作者。