2025年6月12日,清华大学生物医学工程学院副教授刘鹏课题组在《Cell Stem Cell》期刊发表题为 “An organoid co-culture model for probing systemic anti-tumor immunity in lung cancer” 的研究论文。该研究建立了一种临床来源的肿瘤类器官“胶-液界面式”(Gel-liquid interface, GLI)共培养免疫模型,可有效模拟肺癌患者体内局部肿瘤微环境与外周免疫系统之间的互作。基于这一特性,该研究在借助共培养模型的免疫药敏响应准确反映肺癌患者临床免疫疗效的同时,依托多组学分析手段进一步揭示了模型中外周血来源的肿瘤反应性T细胞所参与的肿瘤免疫进程及其分子表达特征。
研究背景
肺癌是全球发病率和致死率最高的恶性肿瘤之一。近年来,免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)显著改善了部分晚期肺癌患者的预后,但总体的患者客观缓解率仍有待提高,亦凸显了预测肿瘤患者临床免疫疗效的必要性。然而,现有预测指标(如PD-L1表达、T细胞浸润程度、肿瘤突变负荷等)仍然普适性不足,难以精准指导免疫治疗。
越来越多的研究发现,抗肿瘤免疫应答不仅受肿瘤局部微环境(Tumor microenvironment, TME)调控,还依赖外周免疫系统(如外周血、引流淋巴结等)的协同参与。因此,亟需建立一种能够系统纳入患者局部与外周免疫成分的体外肿瘤模型,为个性化治疗决策和机制研究提供支持。
研究目的
l构建可增强肿瘤类器官-免疫细胞互作的高效共培养体系以反映临床疗效
当前大多数类器官免疫模型由于缺乏外周免疫系统成分,难以全面模拟肿瘤细胞与系统免疫细胞之间的相互作用。同时,现有类器官共培养模型在促进肿瘤类器官与免疫细胞有效互作方面仍存在显著局限。因此,亟需开发一种能够增强二者互作效率的体外模型,从而更真实地重现患者体内的肿瘤免疫响应进程。
l以类器官为视角解析免疫检查点抑制剂诱导的系统性抗肿瘤免疫响应
在目前的肿瘤免疫治疗研究中,动物模型为我们提供了良好的机制研究载体,但仍需考虑物种差异所带来的影响;而面向患者肿瘤组织所开展的多组学分析研究虽采用了人源样本,但难以在同一患者中纳入多种治疗策略且未能充分反映肿瘤免疫的动态过程。因此,建立一种患者来源的系统性肿瘤免疫体外模型,不仅有助于预测临床免疫疗效,也为依托模型深入解析ICIs介导的免疫动态过程提供了重要载体。
总体框架
本研究围绕GLI共培养模型,系统开展了临床应用探索与免疫进程解析的多层次研究(图1):
●构建了基于患者肺癌类器官(Lung cancer organoids, LCOs)及其外周血单核细胞(Peripheral blood mononuclear cells, PBMCs)的GLI共培养体系,有效增强了类器官与外周免疫细胞之间的互作效率;
●基于34例肺癌患者临床队列,验证了以GLI模型的免疫药敏响应准确反映临床免疫疗效的能力;
●结合自主开发的功能性单细胞转录组测序技术,揭示了PBMCs中肿瘤反应性T细胞的分化轨迹及其分子特征,并解析了其与免疫治疗响应相关的潜在预测标志物。
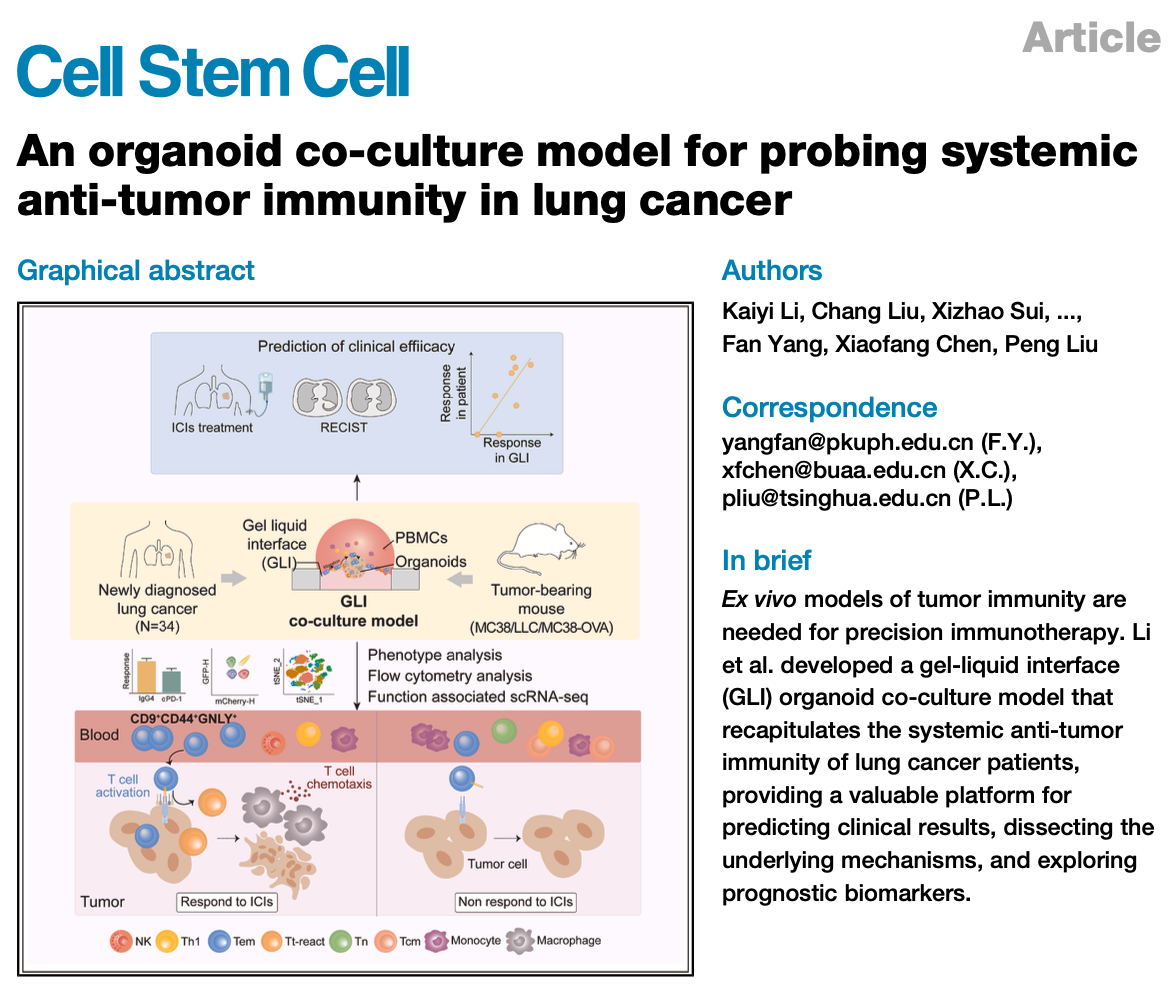
图1 GLI类器官共培养模型解析肺癌系统性抗肿瘤免疫进程
主要结果
本研究设计了一种胶液界面式超疏水微阵列芯片(Gel-liquid interface superhydrophobic microwell array chip,GLI-SMARchip),在1.5 μL的液滴单元内构建LCOs与PBMCs的共培养体系。该模型使肿瘤类器官聚集于基质胶层表面,而PBMCs悬浮于上层培养基中,从而在胶-液界面形成稳定的空间接触,有效促进类器官与免疫细胞间的接触作用,从而模拟局部TME与系统性免疫细胞之间的协同关系。基于该策略所构建的小鼠及肺癌患者体外模型均呈现了良好的免疫细胞浸润与肿瘤免疫反应进程(图2)。
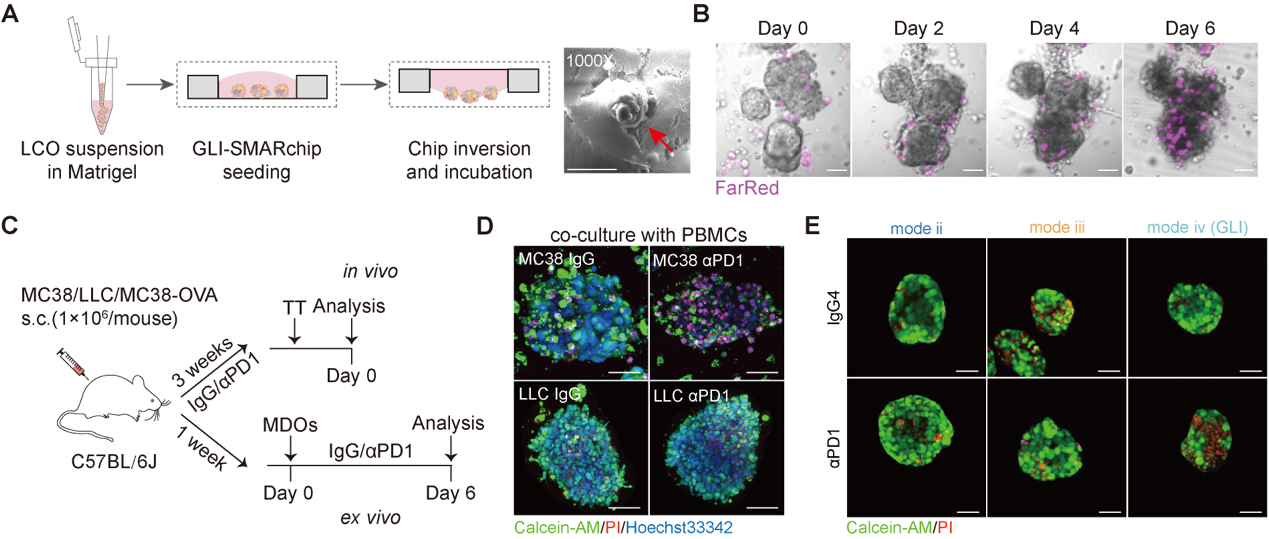
图2 不同种属的GLI类器官共培养模型的构建与验证
研究共建立了34例肺癌患者来源的GLI共培养模型,涵盖腺癌、鳞癌及小细胞肺癌亚型。通过评估免疫治疗(PD-1单抗或联合化疗)后的响应指数(Response index, Ri),发现Ri与患者实际临床疗效高度一致(R = 0.89)。尤其在9例接受真实免疫治疗的患者中,GLI模型可准确区分临床部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)人群。相比之下,缺乏PBMCs的类器官单培养模型(LCO)未能有效预测疗效,提示系统性肿瘤免疫的模拟对于准确反映临床免疫疗效至关重要(图3)。
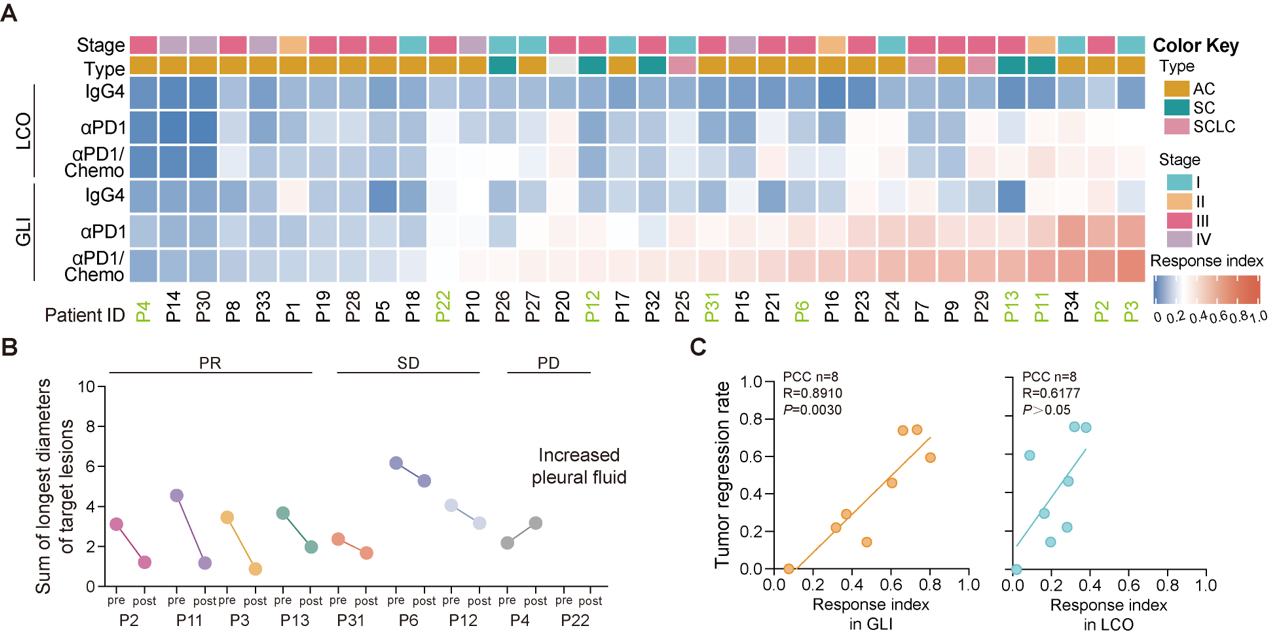
图3 GLI类器官共培养模型的免疫药敏响应可反映肺癌临床免疫疗效
通过对共培养模型开展功能性单细胞转录组测序,可发现αPD1治疗响应组患者的PBMCs中存在更高比例的效应记忆T细胞(Tem)。而拟时序与真实时间线组别相结合的分析共同表明,Tem在与LCOs共培养接触的过程中逐渐转变为了具有更高细胞毒性和激活特征的肿瘤反应性T细胞(Tt-react),从而促成了更为显著的免疫治疗响应(图4)。
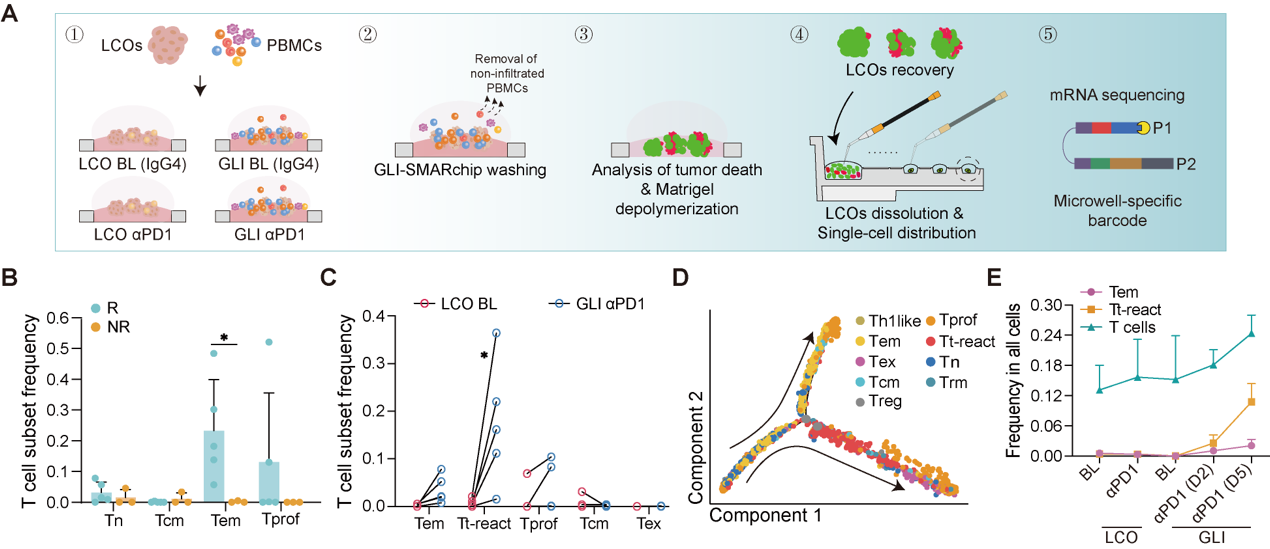
图4 PBMCs中的效应记忆T细胞具有肿瘤反应性潜能
通过将肿瘤杀伤表型与单细胞转录组数据进行整合分析,研究鉴定出GNLY、CD44 和 CD9三基因在Tt-react群体中持续高表达,且与αPD1治疗响应显著相关。这三种标志物不仅在多例肺癌患者样本中得到验证,亦在TCGA肺癌队列中与患者总生存期(OS)呈正相关(图5),显示出潜在的临床预测价值。
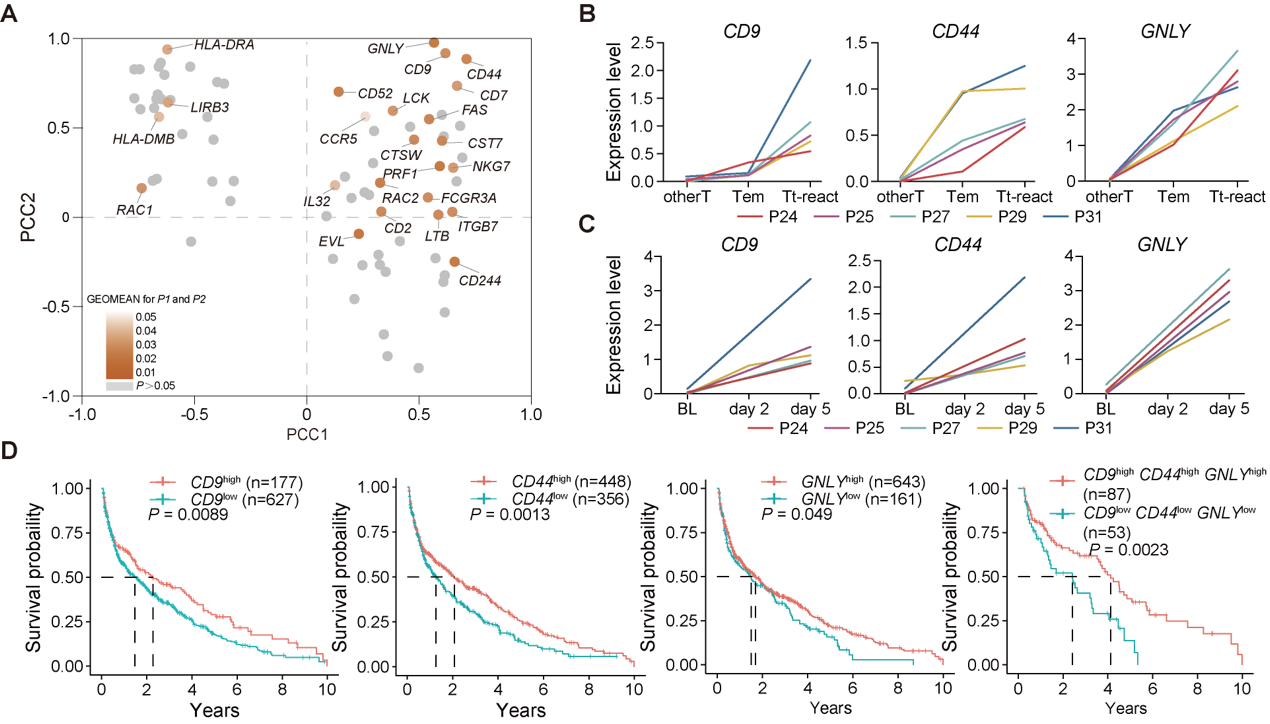
图5 CD9, CD44与GNLY可共同表征外周血中具备肿瘤反应性潜力的T细胞
进一步归纳不同患者模型的免疫响应模式,研究发现对αPD1治疗存在“双响应”(即LCO与GLI模型皆存在响应)的患者中,其PBMCs具备更高比例的干性与增殖特征的T细胞亚群(Tprof),且其类器官微环境中富集了促进T细胞募集的巨噬细胞和树突状细胞亚型;而在“单响应”(仅GLI共培养模型存在响应)的患者中,则主要依靠部分上皮细胞对T细胞的趋化作用,以及进一步的T细胞内部正反馈激活与招募效应。这一现象进一步表明,肺癌患者对免疫治疗的响应结果是由肿瘤微环境与外周免疫状态共同决定的(图6)。
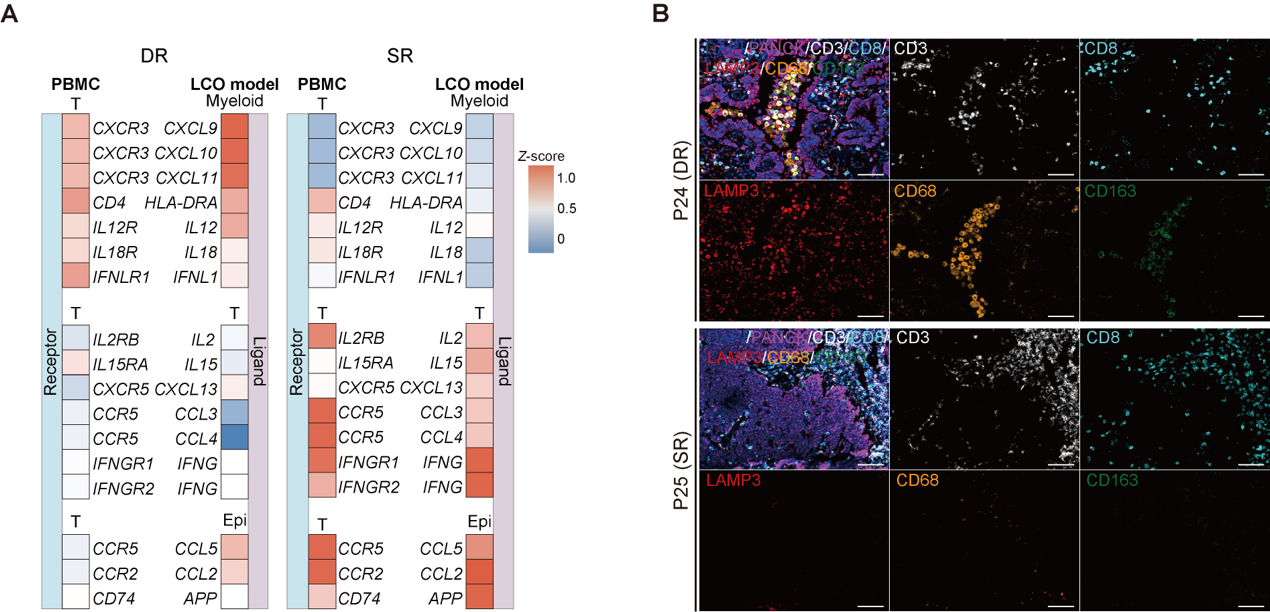
图6 具有不同免疫响应模式的患者模型中存在的外周血T细胞与肿瘤微环境异质性
综上所述,本研究所构建的GLI类器官-免疫细胞共培养模型,首次在体外重构了肺癌患者系统性肿瘤免疫成分并模拟了相应的肿瘤免疫响应进程,突破了传统模型在系统免疫评估方面的局限。该模型不仅可用于预测免疫治疗响应,亦可通过多组学手段解析模型中的肿瘤免疫机制,从而描绘肿瘤反应性T细胞的发育路径及其分子特征,为个性化免疫治疗策略的制定提供强有力的支持。该平台有望拓展至多种肿瘤类型,并广泛应用于药物筛选、细胞疗法以及精准医疗等领域。
清华大学生物医学工程学院刘鹏副教授、北京航空航天大学生物医学工程学院陈晓芳副教授、北京大学人民医院胸外科杨帆主任医师为该文章的通讯作者。清华大学生物医学工程学院李恺怡博士、刘畅博士及北京大学人民医院隋锡朝主任医师为共同第一作者。清华大学生物医学工程学院博士生张婷、硕士生张栋以及北京大学人民医院李超博士等对本研究有重要贡献。研究工作获得国家自然科学基金重点项目(82472173、22127804,31971325)等支持。
论文链接:https://doi.org/10.1016/j.stem.2025.05.011