可预见,以新冠、猴痘和基孔肯雅热等为代表的新发和突发感染性疾病将长期威胁全球公共卫生安全,具备快速、精准且广覆盖能力的现场可及诊断技术,是遏制疫情扩散的关键。凭借“超灵敏、高特异和模块化”等特性,CRISPR诊断技术被视为下一代分子诊断平台,是快速响应新发突发感染性疾病的重要技术候选。然而,由于CRISPR系统顺式切割主导的前置扩增拮抗效应,目前绝大多数CRISPR诊断技术仍依赖“核酸扩增–终点检测”的串行流程,操作复杂且污染风险较高;同时,在CRISPR反式切割主导的体系间信号交叉干扰影响下,主流CRISPR诊断技术普遍缺乏稳健的多重检测能力,尚未形成完善的内部质量控制体系,上述因素共同制约了其临床转化与规模化应用。在此背景下,探索真正意义上的“一管式”(one-pot)多重CRISPR检测新策略具有重要意义。
2025年11月21日,清华大学生物医学工程学院胡晔教授和吐露港生物科技有限公司王金博士领衔国际合作团队,在《Nature Communications》发表题为“热控一管式CRISPR猴痘现场监测系统”(Thermally programmed one-pot CRISPR assay for on-site pandemic surveillance)的研究论文(点击此处查看更多论文信息)。该研究提出并验证了一种简易的一管式热调控异步CRISPR检测策略(thermally regulated asynchronous CRISPR-enhanced assay,TRACE)。该策略巧妙利用重组酶聚合酶扩增(RPA)、Cas12a和Cas12b检测系统之间的温度偏好差异,在同一反应体系内实现扩增与检测模块的空间耦合和时间解耦,首次构建了真正意义上的单步多重CRISPR检测系统,可在单管反应中同时检测病原靶标基因(如猴痘病毒J2L)和宿主内部质控基因(如RNase P)。在目前已报道的最大猴痘临床验证队列上,开展回顾性验证和前瞻性现场评估,TRACE最短11分钟即可完成检测,总体准确率高达99.5%。该技术克服了CRISPR诊断临床转化面临的关键技术障碍,有望成长为符合世界卫生组织(WHO)提出的“ASSURED”标准的现场即时检测关键平台,为未来突发传染病的快速监测与应急响应提供重要技术支撑(图1)。

图1 TRACE工作流程及关键技术指标
热调控异步CRISPR机制
在传统单管RPA–CRISPR检测系统中,CRISPR对扩增子的顺式切割效应会显著抑制RPA扩增,限制扩增子积累,从而降低整体检测灵敏度。在此基础上,TRACE反应利用RPA(约37℃)与Cas12b(约60℃)之间的最适温度差异,设计了两步温度程序反应机制,在同一体系内实现扩增与切割过程的程序性解耦。
1)低温阶段(约37℃):在较低温度下,CRISPR/Cas12b系统活性有限,额外加入的ssRNA阻断子进一步抑制gRNA/Cas12b复合体的形成及其对底物dsDNA的识别,使CRISPR/Cas12b处于功能性“关断”状态;此时RPA等温扩增以高效率运行,扩增产物得以充分积累。
2)高温阶段(约60℃):升温后,RPA失活,ssRNA阻断子解链,gRNA/Cas12b重新组装并高效识别靶序列,驱动明显的荧光信号读出。由此,扩增与切割在单管反应中被“热程序”异步分离,有效避免了传统单管体系中“边扩增、边被切掉”的拮抗效应。
与以往依赖筛选“低效率gRNA”以被动平衡扩增与切割的策略相比,TRACE基于温度偏好差异,在机制层面解决了扩增–切割竞争问题,既保留了单管封闭操作的简洁与生物安全性,又将检测灵敏度提升至最佳水平,其检测限可达2.5 copies/反应,较传统单管方法约提高40倍。在针对约200份各类型标本的回顾性验证中,TRACE最快11分钟完成测试,汇总灵敏度和特异性分别为99%和100%(图2)。

图2 TRACE的分析性能和诊断性能
基于TRACE的现场即时检测
为满足资源有限场景下的现场检测与筛查需求,研究团队开发了一套现场即时检测操作流程。该流程采用冻干保存试剂、简化样本前处理以及层析可视化读数策略,规避了对冷链和大型仪器设备的依赖,显著提升了TRACE在基层现场的可及性和可部署性。
研究团队将TRACE嵌入门诊工作流程,开展前瞻性试点研究(图3)。TRACE成功识别全部28例具有高流行病学风险的有症状个体,其平均“样本到答案”时间仅约25分钟,而qPCR金标准检测则需约3小时,充分表明TRACE在与临床流程兼容的前提下,具备现场快速识别MPXV病例的显著即时检测优势。

图3 基于门诊流程的TRACE试点研究
基于时间分辨的TRACE双重检测
为进一步解决CRISPR检测缺乏内部质控的关键难题,研究团队将CRISPR/Cas12a模块嵌入TRACE反应的低温阶段,用于监测宿主质控基因。鉴于Cas12a与RPA共享相近的最适温度范围,Cas12a在低温阶段被激活并在高温阶段自然失活;相应地,高温阶段仅Cas12b处于活化状态,用于识别病原体靶基因。由此,两个阶段中产生的荧光信号增量可被清晰地解卷积并分别归因于宿主内参基因与MPXV病原靶标,在单一报告体系下实现宿主–病原双靶标检测。尽管在第一阶段内参检测中,RPA与Cas12a之间存在扩增–切割拮抗,导致内参检测灵敏度一定程度下降,但对高丰度宿主内参基因的定性识别并不构成实质影响,仍可提供稳健的内部质控读数;同时,温度异步调节策略确保第二阶段CRISPR/Cas12b对病原基因的检测灵敏度不受影响(图4)。
为支撑TRACE宿主–病原双重检测技术在资源有限场景的实际部署,研究团队同步开发了一款小型、低成本且便携的专用读数设备。依托该双重检测策略及其便携式终端,研究团队在23份临床样本中成功识别出1例质量受限样本,有效提示样本处理或采集问题,凸显了在CRISPR检测体系中嵌入内部质控标准对于保障现场检测可靠性的关键意义。
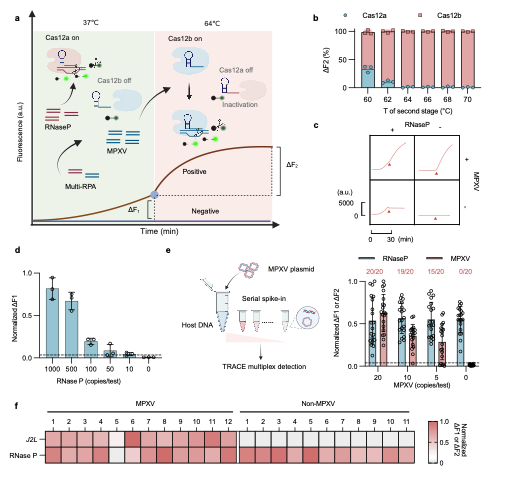
图4 TRACE双重检测
本研究提出了一种简便的热调控异步CRISPR检测策略,有望为应对CRISPR检测从实验室研究向临床应用转化过程中面临的关键障碍提供可扩展的解决方案。目前,研究团队正将该技术进一步拓展应用于多种感染性疾病的诊断。
清华大学生物医学工程学院胡晔教授、吐露港生物科技有限公司王金博士、深圳市国家感染性疾病临床医学研究中心卢水华教授、复旦大学附属上海市公共卫生临床中心范小勇教授为该文章的共同通讯作者。杜兰大学黄震助理教授、复旦大学博士生东亚娟、深圳市第三人民医院杨杨博士和吐露港生物科技有限公司韩绪春为论文共同第一作者。本研究获得国家自然科学基金(82302614,31922046)、浙江省“领雁计划”研发计划(2023C03045)、广东省医学科研基金(A2023170)和广东省基础与应用基础研究基金(2025A1515011871)的资助。