近日,清华大学生物医学工程学院苑克鑫教授团队在《Cell》期刊发表题为“VIVIT: Resolving trans-scale volumetric biological architectures via ionic glassy tissue” 的研究论文,首次提出并验证了一种全新的生物组织处理方法VIVIT,实现了组织在玻璃态下的高保真三维成像。VIVIT同时突破了组织透明化领域的三个技术瓶颈:透明与无形变不能同时实现、荧光信号衰减、不兼容无损冷冻保存与切片,为包括脑科学在内的基础研究、病理分析、AI辅助诊断等应用打开了新的空间。

三维组织结构承载着丰富的生物信息,是理解生物体功能与疾病病理的核心依据。但长期以来,研究人员对它的理解几乎都依赖于二维切片:样本要被切成几十甚至上百层,再逐张拼接还原。这不仅耗时耗力,还容易因物理切割造成组织变形或结构断裂,导致空间信息缺失和误判。
为此,组织透明化技术逐步兴起,通过化学方法使完整组织变得光学透明,进而在不切片的前提下直接实现深层成像。但受限于处理过程中组织膨胀收缩、荧光信号损耗、冷冻易损等难题,目前多数方案仍在结构稳定性、信号强度与染色处理等核心指标上难以兼顾。
VIVIT则为这一长期困境提供了创新解决方案。与传统组织透明化技术不同,VIVIT 并不仅仅追求“透明”,而是在透明的同时,尽可能保留组织原始的结构与荧光信号。通过团队自主研发的高折射率离子液体,VIVIT首次实现了将不透光的生物组织在低温下转变为“玻璃态”,既稳定,又通透。在整个处理过程中,组织几乎不会膨胀或收缩,形变幅度在1%以内。即便是如脑组织这类结构精密、连接复杂的样本,也能在VIVIT处理后保持其原始结构,从而使包括神经突触在内的亚细胞级精细结构得以清晰呈现,正如该团队在文章中使用啮齿类、非人灵长类和人类脑组织所展示的那样。


【VIVIT让组织实现透明化】
VIVIT 的核心突破不止于“看得清”,也在于“保得住”和“用得上”。实验显示,在经过离子液体处理后,多种常见荧光染料的信号强度可提升至原始的2到30倍,使以往组织中难以检测的微弱标记也能清晰可见。同时,由于其玻璃态的物理性质,VIVIT也打破了生物样本冷冻保存的限制,样本可在-80℃下长期保存,避免了因冰晶形成而导致的撕裂与机械性损伤,真正实现了结构无损的冷冻切片与高超分辨成像。VIVIT的结构保真能力和信号稳定性,为跨尺度组织三维数据获取与空间重建奠定了坚实的基础。
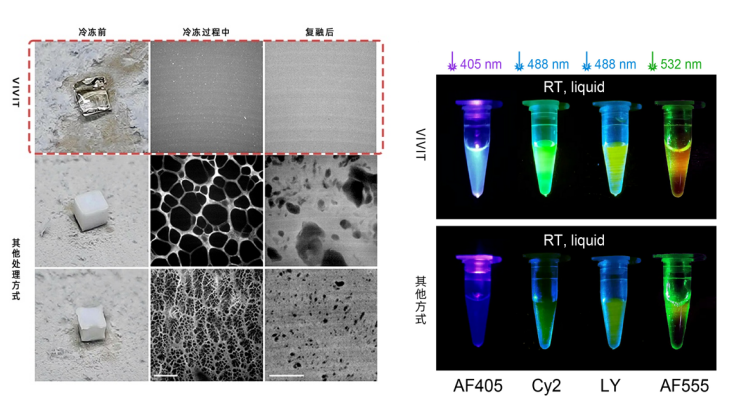
【经过VIVIT处理后的样本无冰晶损伤(左)】
【VIVIT能够实现多倍增强荧光,且抑制光淬灭(右)】
基于VIVIT的这一独特优势,苑克鑫团队将小鼠多模态感觉丘脑神经元在突触输入(微观)方面的感觉模态偏好性与在全脑输出(介观和宏观)方面的目标脑区偏好性定量化地联系了起来,而这也是国际上首次实现单神经元水平输入-输出的准确链接。这突破了神经环路研究领域的技术瓶颈,为深入解析脑功能的神经环路机制提供了新的机遇。
不仅如此,经过VIVIT处理后的组织仍可进行多轮免疫染色,且每一轮染色成像后的荧光信号依然清晰,组织结构保持稳定。这就使得研究者能在同一样本上依次识别多个分子靶点,获取更丰富的空间信息。与此同时,结合团队自研的重建算法TARS,VIVIT也支持组织连续切片的图像拼接,可构建从亚细胞到全器官的三维图谱,实现生物结构的跨尺度还原。

【VIVIT重构脑组织三维全景】
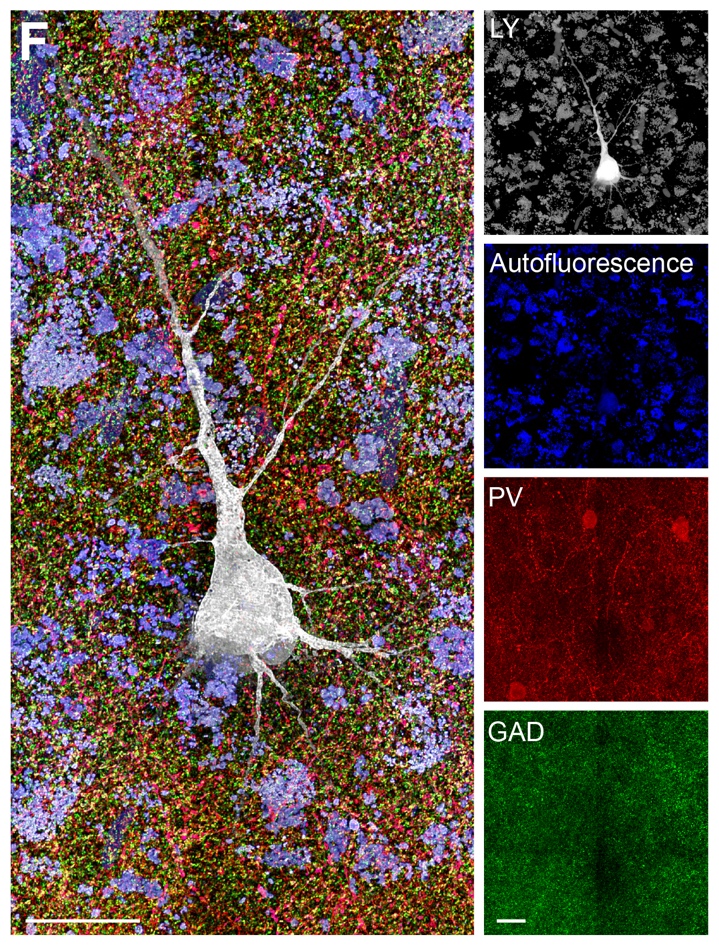
【VIVIT技术揭示人类大脑皮层的微连接】
从组织透明化到多模态染色再到三维重建,VIVIT提出了一套贯穿样本处理与空间结构分析的完整技术路径,为高分辨、跨尺度的空间数据获取和组织建模提供了系统化解决方案。
未来,苑克鑫教授团队将继续推进 VIVIT 技术在脑科学领域的应用,并在更为广泛的生命科学领域以及精准医疗与智慧诊断等领域开展应用探索,释放其空间结构信息更大的科研与临床应用价值。
【文章链接:】https://doi.org/10.1016/j.cell.2025.07.023
【研究团队介绍:】
清华大学生物医学工程学院苑克鑫团队围绕两个既密切相关又相互独立的重要问题-多模态感觉信息的整合机制和感知障碍的病理机制,系统性地开展了跨学科、跨尺度、跨物种的原创性研究,近年来作为通讯作者在Cell (2025)、Neuron (2023)、IEEE TPAMI (2024)、J. Neurosci. (2024)、Cereb. Cortex (2019) 等国际主流期刊发表了系列文章。